아이오딘화 수소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
아이오딘화 수소(HI)는 분자량이 127.90인 무색 기체로, 녹는점은 −50.8 ℃, 끓는점은 −35.1 ℃이다. 물에 매우 잘 녹아 아이오딘화 수소산을 생성하며, 강산 중 하나로 pKa는 -10이다. 환원력이 강하며, 공기 중의 산소와 반응하여 아이오딘을 생성한다. 아이오딘화 수소산은 57% 수용액으로 시판되며, 산업적으로는 히드라진과 아이오딘을 반응시켜 제조하거나, 황화 수소 증기를 아이오딘 수용액에 통과시켜 얻을 수 있다. HI는 알켄에 첨가되거나, 유기 화학에서 알코올을 알킬 아이오다이드로 전환하는 데 사용되며, 에테르를 알킬 아이오다이드와 알코올로 분해하는 데에도 사용된다.
더 읽어볼만한 페이지
- 아이오딘화물 - 아이오딘화 질소
아이오딘화 질소는 질소 원자에 세 개의 요오드 원자가 결합되어 극도로 불안정하며 작은 충격에도 폭발하는 화합물로, 요오드와 암모니아 반응을 통해 합성되고 높은 입체 변형과 낮은 활성화 에너지로 인해 분해 시 많은 열을 방출하여 폭발 위험성이 높아 취급에 주의가 필요하다. - 아이오딘화물 - 아이오딘화 칼륨
아이오딘화 칼륨은 의학, 산업, 영양 등 다양한 분야에서 활용되는 이온 화합물로, 특히 방사성 요오드 노출 시 갑상선 보호 효과와 요오드 결핍 예방에 사용된다. - 수소 화합물 - 인산
인산은 화학식 H₃PO₄를 가지며, 인광석을 이용한 습식 또는 건식 공정으로 생산되어 비료, 식품 첨가물, 세제, 의약품, 금속 처리 등 다양한 산업 분야에 사용되는 인 화합물이다. - 수소 화합물 - 질산
질산은 강산이자 강력한 산화력을 지닌 무색 액체로, 비료, 폭발물, 나일론 생산 등 산업에 널리 쓰이지만 부식성과 테러 악용 위험성도 있으며, 현재는 주로 암모니아 산화법으로 생산된다. - 표시 이름과 문서 제목이 같은 위키공용분류 - 라우토카
라우토카는 피지 비치레부섬 서부에 위치한 피지에서 두 번째로 큰 도시이자 서부 지방의 행정 중심지로, 사탕수수 산업이 발달하여 "설탕 도시"로 알려져 있으며, 인도에서 온 계약 노동자들의 거주와 미 해군 기지 건설의 역사를 가지고 있고, 피지 산업 생산의 상당 부분을 담당하는 주요 기관들이 위치해 있다. - 표시 이름과 문서 제목이 같은 위키공용분류 - 코코넛
코코넛은 코코넛 야자나무의 열매로 식용 및 유지로 사용되며, 조리되지 않은 과육은 100g당 354kcal의 열량을 내는 다양한 영양 성분으로 구성되어 있고, 코코넛 파우더의 식이섬유는 대부분 불용성 식이섬유인 셀룰로오스이며, 태국 일부 지역에서는 코코넛 수확에 훈련된 원숭이를 이용하는 동물 학대 문제가 있다.
2. 성질
아이오딘화 수소(HI)는 분자량이 127.90이며, 녹는점은 -50.8°C, 끓는점은 -35.1°C이다. 아이오딘과 수소는 전기 음성도 차이가 거의 없어 분자의 극성은 작지만, 아이오딘화 이온의 이온 반경이 크고 수소 이온과의 정전기력이 작아 전리되기 쉬우므로, 아이오딘화 수소는 강산이 된다. (p''K''a = −10). 환원력이 강하고, 공기 중의 산소에 닿으면 쉽게 산화되어 아이오딘의 붉은 자색을 띤다.
물에 매우 잘 녹는 기체이며, 수용액은 '''아이오딘화 수소산'''(hydroiodic acid)이라고 불린다. 염화 수소 및 브로마이드화 수소와 마찬가지로 물에 대한 용해열은 매우 크다.
:
2. 1. 물리적 성질
HI는 무색 기체로, 산소와 반응하여 물과 아이오딘을 생성한다. 습한 공기 중에서는 아이오딘화 수소산의 미스트(또는 연기)를 생성한다. 물에 매우 잘 녹으며, 1리터의 물은 425리터의 HI 기체를 녹일 수 있다. 가장 농축된 용액은 HI 분자당 4개의 물 분자만을 갖는다. 분자식은 HI이고, 분자량은 127.90, 녹는점은 −50.8 ℃, 끓는점은 −35.1 ℃이다. 강산 중 하나이다(p''K''a = −10).2. 2. 화학적 성질
HI는 강산 중 하나이며(p''K''a = -10), 이는 아이오딘(아이오딘 이온)의 이온 반경이 커서 수소 이온과의 정전기력이 작아 전리되기 쉽기 때문이다. 염화 수소 및 브롬화 수소보다 강한 산성을 띠는데, 이는 아이오딘 이온의 반지름이 커서 음전하가 넓은 공간에 분산되기 때문이다. 강한 환원력을 가지며, 공기 중의 산소에 닿으면 쉽게 산화되어 요오드의 붉은 자색을 띤다.아이오딘화 수소산(hydroiodic acid)은 주로 57% 수용액(d=1.70g cm−3, 7.6mol dm−3)이 시판되고 있다.
아래는 물에서의 해리 상수이다.
- HI(g) + H2O(l) → H3O+(aq) + I−(aq) ''K''a ≈ 1010
- HBr(g) + H2O(l) → H3O+(aq) + Br−(aq) ''K''a ≈ 109
- HCl(g) + H2O(l) → H3O+(aq) + Cl−(aq) ''K''a ≈ 106
:HI(g) <=> H+(aq) + I-(aq),
2. 3. 요오드화 수소산
아이오딘화 수소산은 순수한 아이오딘화 수소가 아니라 이를 포함하는 혼합물이다. 상업용 "농축" 아이오딘화 수소산은 보통 질량 기준으로 48–57%의 HI를 함유한다. 이 용액은 127°C에서 57% HI, 43% 물로 구성된 공비 혼합물을 형성한다. 높은 산도는 음이온에 이온 전하가 분산되기 때문에 발생한다. 아이오딘 이온의 반지름은 다른 일반적인 할로겐보다 훨씬 크며, 이로 인해 음전하가 넓은 공간에 분산된다. 반대로, 염화물 이온은 훨씬 작으므로 음전하가 더 집중되어 양성자와 염화물 이온 간의 더 강한 상호 작용을 유발한다. HI에서 이러한 약한 H+···I− 상호 작용은 음이온으로부터 양성자의 해리를 촉진하며, HI가 가장 강한 할로겐화 수소산인 이유이다.물에 매우 잘 녹는 기체이며, 수용액은 '''아이오딘화 수소산'''(hydroiodic acid)이라고 불리며, 주로 57% 수용액(d=1.70g cm−3, 7.6mol dm−3)이 시판되고 있다. 염화 수소 및 브로마이드화 수소와 마찬가지로 물에 대한 용해열은 매우 크다.[2]
3. 합성
아이오딘화 수소는 산업적으로 아이오딘(I2)과 하이드라진을 반응시켜 제조하며, 이 과정에서 질소 기체도 생성된다.[7]
:2 I2 + N2H4 → 4 HI + N2
이때 물을 사용하여 반응을 진행하면, 생성된 HI를 증류해야 한다.
또한, 농축된 인산 속의 아이오딘화 나트륨(NaI) 또는 다른 알칼리 금속 아이오딘화물 용액으로부터 HI를 증류할 수도 있다. 하지만 농축된 황산은 아이오딘화물을 산화시켜 원소 형태의 아이오딘으로 만들기 때문에 사용할 수 없다.
황화 수소 증기를 아이오딘 수용액에 통과시키면 아이오딘화 수소산(증류를 통해 얻음)과 원소 황(여과를 통해 얻음)이 생성된다.[8]
:H2S + I2 → 2 HI + S
HI는 수소(H2)와 아이오딘(I2)을 결합하여 제조할 수도 있다. 이 반응은 가역 반응이며 250°C 조건에서 진행된다.
:H2 + I2 → 2 HI
이 방법은 보통 고순도 샘플을 얻는 데 사용된다.
오랫동안 이 반응은 H2와 I2 분자 사이의 단순한 이분자 반응으로 여겨졌다. 그러나 기체 혼합물에 I2의 결합 해리 에너지와 같은 파장(약 578 nm)의 빛을 쬐면 반응 속도가 크게 증가한다. 이는 I2가 먼저 2개의 아이오딘 원자로 해리되고, 각 아이오딘 원자가 H2 분자의 한쪽에 붙어 H−H 결합을 끊는 메커니즘을 뒷받침한다.[9]
:H2 + I2 + (578 nm radiation) → H2 + 2I → I···H···H···I → 2HI
실험실에서는 삼요오드화 인(PI3)을 가수분해하여 HI를 만들기도 한다. PI3는 삼브로민화 인(PBr3)의 아이오딘 유사체이다. 이 방법에서는 I2를 인과 반응시켜 삼요오드화 인을 만들고, 이를 물과 반응시켜 HI와 아인산(H3PO3)을 생성한다.
:3 I2 + 2 P + 6 H2O → 2 PI3 + 6 H2O → 6 HI + 2 H3PO3
요오드와 물을 섞은 혼합물을 냉각하면서 적린을 첨가하면 다음과 같은 반응이 일어난다.
:2P + 5I2 + 8H2O → 10HI + 2H3PO4
4. 주요 반응 및 응용
아이오딘화 수소 용액은 공기 중에서 쉽게 산화되는 성질을 가지고 있다.
:[10]
는 짙은 갈색을 띠기 때문에, 오래된 아이오딘화 수소 용액은 종종 짙은 갈색으로 보이기도 한다.
아이오딘화 수소는 브로민화 수소(HBr) 및 염화 수소(HCl)와 마찬가지로 알켄에 첨가되는 반응을 일으킨다.[14]
:
또한 아이오딘화 수소는 유기 화학에서 1차 알코올을 알킬 아이오다이드로 전환하는 데 사용된다.[11] 이 반응은 아이오다이드 이온이 "활성화된" 하이드록실기(물)를 대체하는 SN2 치환 반응이다.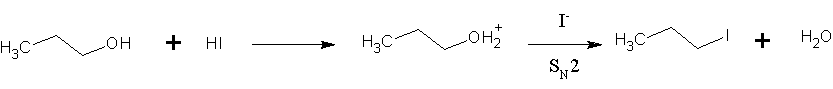
아이오다이드 이온은 브로마이드나 클로라이드 이온보다 친핵성이 훨씬 강하기 때문에, 과도한 가열 없이도 반응이 잘 일어난다. 이러한 이유로 다른 할로젠화 수소보다 아이오딘화 수소가 선호된다. 이 반응은 2차 및 3차 알코올에서도 일어나지만, 이 경우에는 SN1 경로를 통해 치환 반응이 진행된다.
아이오딘화 수소(또는 HBr)는 에테르를 알킬 아이오다이드와 알코올로 분해하는 데 사용될 수 있다. 이 반응은 알코올 치환 반응과 유사하게 진행된다. 이러한 에테르 분해 반응은 화학적으로 안정하고[11] 불활성인 에테르를 더 반응성이 큰 물질로 전환할 수 있다는 점에서 중요하다. 다음은 다이에틸 에테르가 에탄올과 아이오도에테인으로 분해되는 반응의 예시이다.
이 반응은 위치 선택적이며, 아이오다이드 이온은 입체적으로 덜 혼잡한 에테르 탄소를 공격하는 경향을 보인다. 만약 아이오딘화 수소를 과량으로 사용하면, 이 반응에서 생성된 알코올은 1차 알코올이 알킬 아이오다이드로 전환되는 반응과 유사하게 추가적인 아이오딘화 수소와 반응하여 알킬 아이오다이드로 전환된다.
아이오딘화 수소는 염화 수소(HCl) 및 브로민화 수소(HBr)와 마찬가지로 마르코프니코프 및 안티-마르코프니코프 지침을 따른다.
현대 화학의 기준에서는 다소 가혹한 시약으로 여겨질 수 있지만, 아이오딘화 수소는 유기 화학 초기에 환원제로 널리 사용되었다. 19세기 화학자들은 고온에서 아이오딘화 수소를 이용하여 벤젠을 환원시켜 사이클로헥세인을 합성하려고 시도했지만, 실제로는 재배열된 생성물인 메틸시클로펜테인을 얻었다(''사이클로헥세인'' 문서 참조). Kiliani의 초기 보고에 따르면,[12] 당류 및 기타 폴리올을 아이오드화 수소산으로 환원시키면 여러 개, 심지어는 모든 하이드록실기가 환원되어 절단되지만, 수율 및 재현성이 좋지 않은 경우가 많았다.[13] 벤질 알코올이나 α-카르보닐기를 갖는 알코올의 경우, 아이오딘화 수소를 이용한 환원을 통해 해당 탄화수소 생성물을 합성적으로 유용한 수율로 얻을 수 있다.[14] 이 과정은 생성된 I2를 환원시키기 위해 적린을 사용하여 아이오딘화 수소를 촉매적으로 만드는 방법으로 진행할 수 있다.[15]
에테르에 아이오딘화 수소산을 작용시키면 에테르 결합이 끊어지면서 알코올과 아이오딘화 알킬이 생성된다.
:
참조
[1]
서적
The Proton in Chemistry
Cornell University Press
1973
[2]
논문
"Acidity of Strong Acids in Water and Dimethyl Sulfoxide"
2016
[3]
논문
"Acidities of strong neutral Brønsted acids in different media."
2013
[4]
서적
CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data.
https://www.worldcat[...]
2016
[5]
문서
Hydrogen iodide: toxicity
[6]
서적
Inorganic Chemistry
Academic Press
2001
[7]
서적
The Chemistry of the Elements
Butterworth-Heineman
1997
[8]
간행물
A Memoir on Iodine
[9]
서적
Inorganic Chemistry
Academic Press
2001
[10]
논문
Hydrogen Tri-iodide
https://pubs.acs.org[...]
1956-12-01
[11]
서적
Organic Chemistry
Prentice Hall
2003
[12]
논문
Ueber die Constitution der Dextrosecarbonsäure
https://zenodo.org/r[...]
1886-01-01
[13]
논문
Kiliani's Reduction of Glucose and Fructose Cyanohydrins to the Corresponding Heptanoic Acids and Lactones
1953-03-01
[14]
논문
Hydrogen Iodide
J. Wiley & Sons
2004
[15]
논문
Reduction of benzylic alcohols and α-hydroxycarbonyl compounds by hydriodic acid in a biphasic reaction medium
2012-03-02
[16]
웹사이트
毒物及び劇物取締法(昭和二十五年法律第三百三号)別表第二 八十七
https://laws.e-gov.g[...]
2018-06-27
[17]
서적
The Proton in Chemistry
Cornell University Press
1973
[18]
논문
"Acidity of Strong Acids in Water and Dimethyl Sulfoxide"
2016
[19]
논문
"Acidities of strong neutral Brønsted acids in different media."
2013
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

